原创 FSHW 食品科学与人类健康 2024-02-19 14:27 北京
铅通常通过食物和饮用水摄入,过度接触铅可导致广泛的生理、生化和行为障碍。研究表明,铅暴露可显著抑制超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等抗氧化酶活性,降低谷胱甘肽(GSH-Px)水平,改善脂质过氧化反应。铅不仅影响抗氧化防御系统,而且通过引起Fenton样反应和炎症而导致组织损伤。本研究建立了一种小鼠模型,以研究牡蛎铁蛋白减轻铅诱导的氧化损伤的潜力。这些结果为了解铁蛋白在铅中毒肝脏中的潜在保护机制提供了重要的见解,并支持铁蛋白作为一种新型药物或功能食品来预防铅相关性损伤的发展。在实验过程中,随着时间的推移,小鼠的体质量逐渐增加(图1A),但与对照组相比,铅组小鼠的生长受到了显著的影响(P<0.01)。铁蛋白干预组小鼠体质量虽低于对照组,但与铅组比较差异有统计学意义(P<0.01)。如图1B所示,铅暴露使小鼠的肝、脾、肾系数显著增加(P<0.05),而大剂量铁蛋白和DMSA干预可使肝脏增大明显减少(P<0.05)。因此,结果表明,大剂量铁蛋白可能会减轻铅对肝脏的有害影响。测定小鼠血液和肝脏中的铅含量可以直接反映铅的蓄积情况。对照组小鼠铅的来源为食物、饮用水和空气,血和肝中铅的平均水平分别为4.04 μg/L和1.57 μg/g(图1C,D)。与对照组相比,大剂量铁蛋白干预后,铅组大鼠血铅水平明显升高,血铅水平显著降低。ALT和AST已被确定为评估肝功能的标志酶,当肝细胞受损时,它们的水平会发生变化。结果(图1E,F)显示,与对照组相比,铅组ALT和AST水平显著升高。但大剂量铁蛋白可有效降低ALT、AST水平,大剂量铁蛋白可减轻铅损伤后GGT、TBIL水平的异常升高。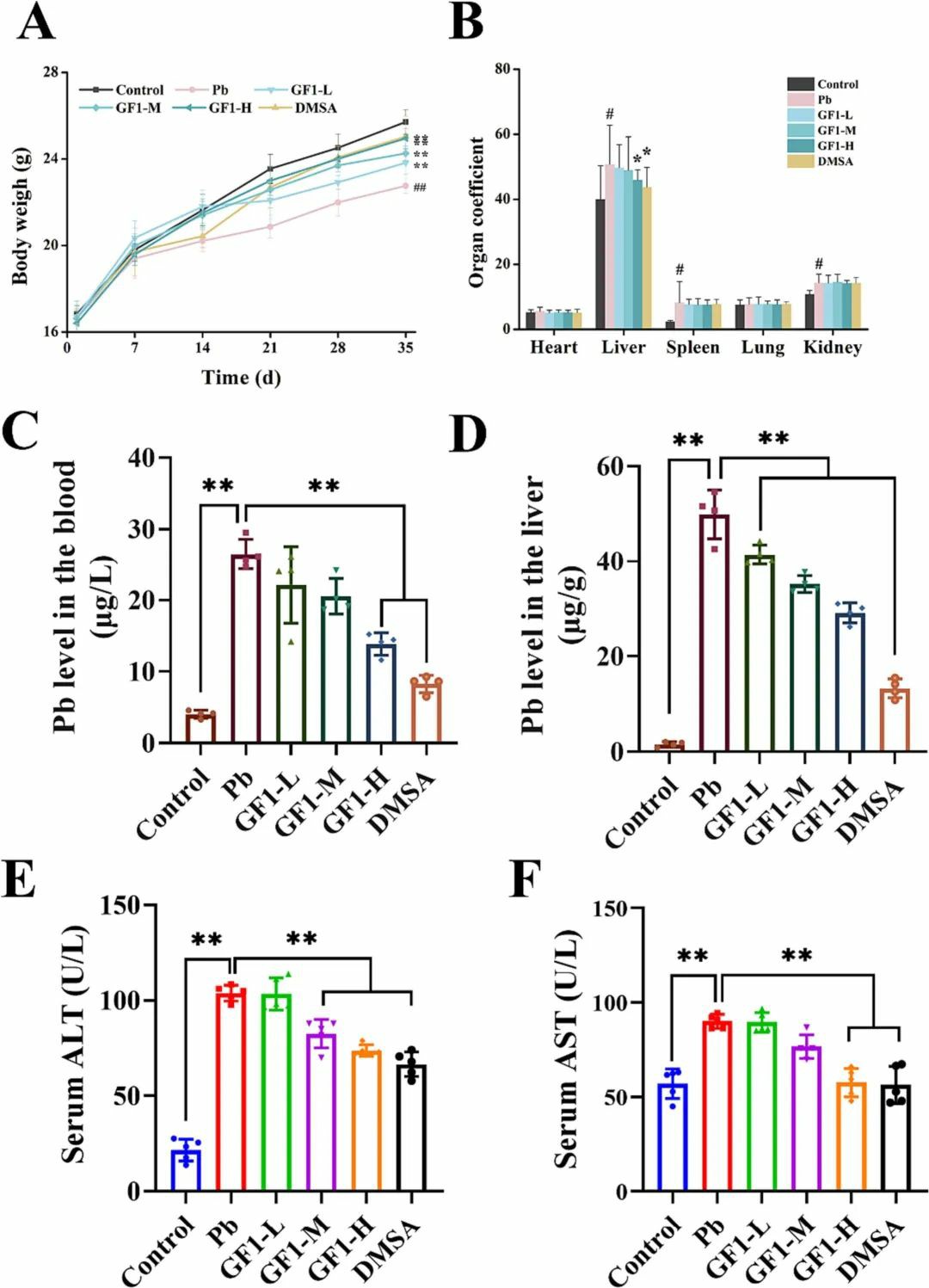
图1 牡蛎铁蛋白(GF1)和DMSA对铅致小鼠肝损伤的治疗效果牡蛎铁蛋白对铅中毒氧化损伤的调节及减轻病理损伤的作用在铅染毒组小鼠肝脏中,如图2A-C所示,关键抗氧化酶--超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的活性显著降低,表明肝脏的解毒或抗氧化能力下降。如图2D所示,对照组肝细胞胞浆丰富,核仁突出,无肿胀、变形等病理现象。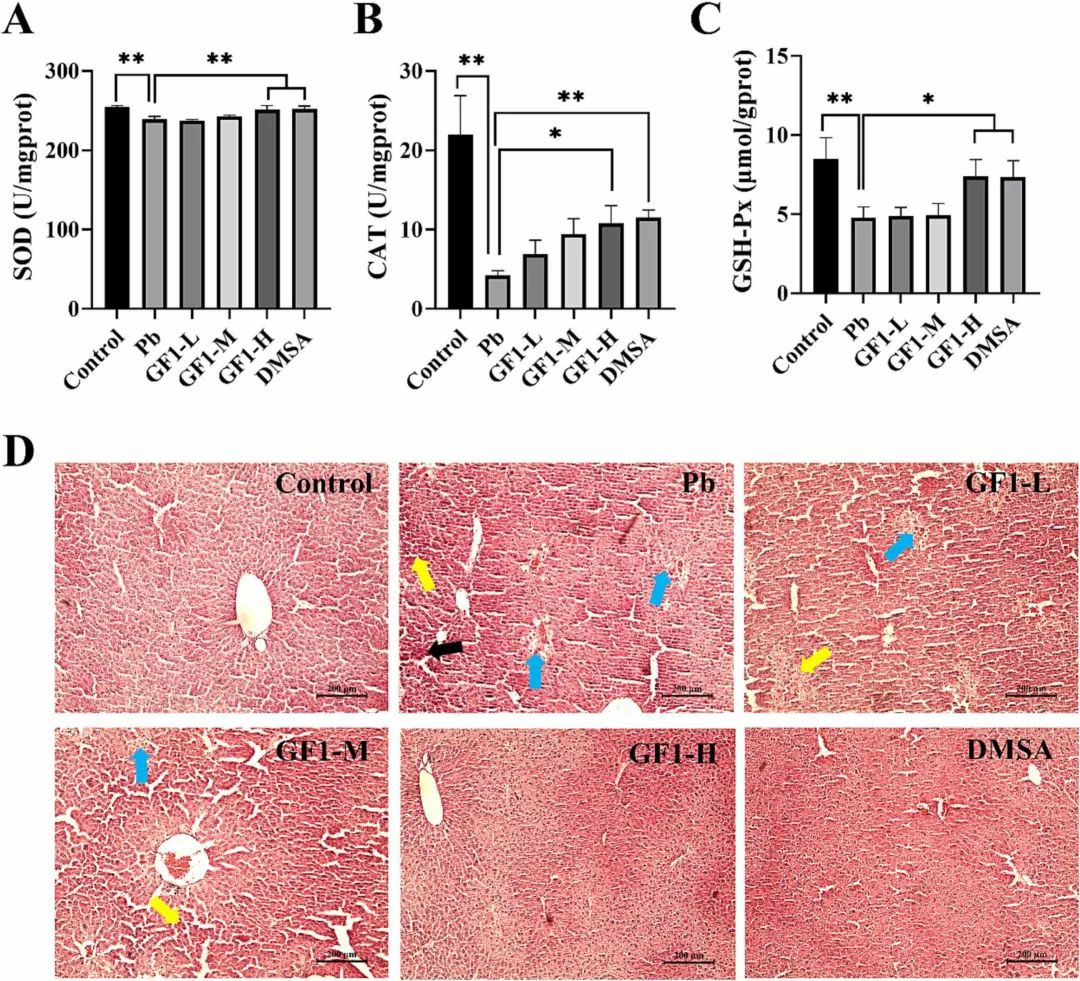
图2 铅致小鼠肝损伤时肝脏的氧化酶活性和组织病理学变化如图3A所示,染铅小鼠的丙二醛呈明显上升趋势,牡蛎铁蛋白中、高剂量干预可显著降低脂质过氧化水平。如图3B所示,与对照组相比,铅组小鼠的脂滴生成增加,肝脏小叶结构紊乱,证实了H&E染色的结果。铁蛋白干预可抑制小鼠体内脂滴的过度生成,且浓度越高,越接近对照组。提示氧化应激和脂质过氧化均是铅性肝损伤的潜在机制,牡蛎铁蛋白具有明显的缓解作用。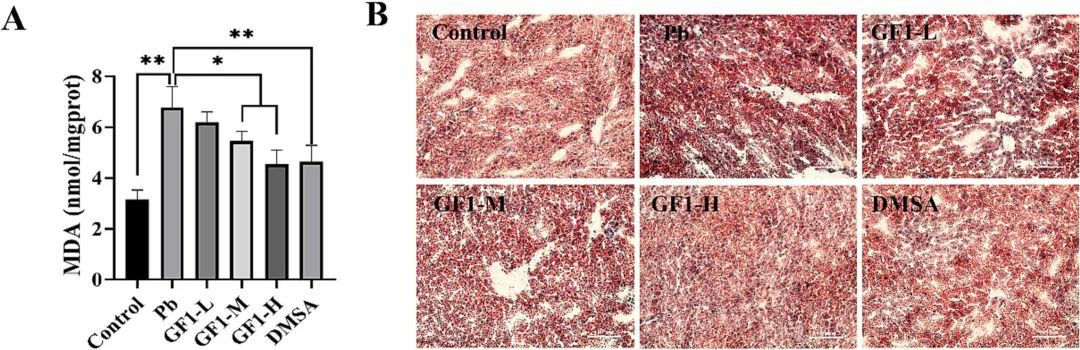
牡蛎铁蛋白逆转铅诱导的Nrf2和NLRP3途径的抑制或激活激活Nrf2途径可以上调Nrf2和包括HO-1在内的II相解毒酶的表达,维持体内氧化还原平衡。因此,评估了Nrf2及其下游基因(包括HO-1、Gclc和Gclm)的表达(图4A)。结果表明,与对照组相比,染铅组大鼠肺组织中Nrf2、HO-1、GCLC、GCLM的表达水平显著降低(P<0.01)。铁蛋白干预组Nrf2、HO-1、GCLC、GCLM水平均显著高于铅组(P<0.01),其中以高剂量组最为显著。结果表明,铅暴露可通过耗尽体内的Nrf2蛋白来破坏抗氧化系统。有证据表明,Nrf2可以促进NLRP3的激活。为了进一步研究Nrf2与NLRP3炎症小体的关系,检测了NLRP3的相关蛋白。结果(图4B)显示,与对照组相比,铅暴露显著增加了肝脏中NLRP3、caspase-1和IL-18的表达。然而,铁蛋白干预减少了这些变化。因此,这些发现表明,铁蛋白对小鼠肝脏中NLRP3炎症体的激活具有负性调节作用。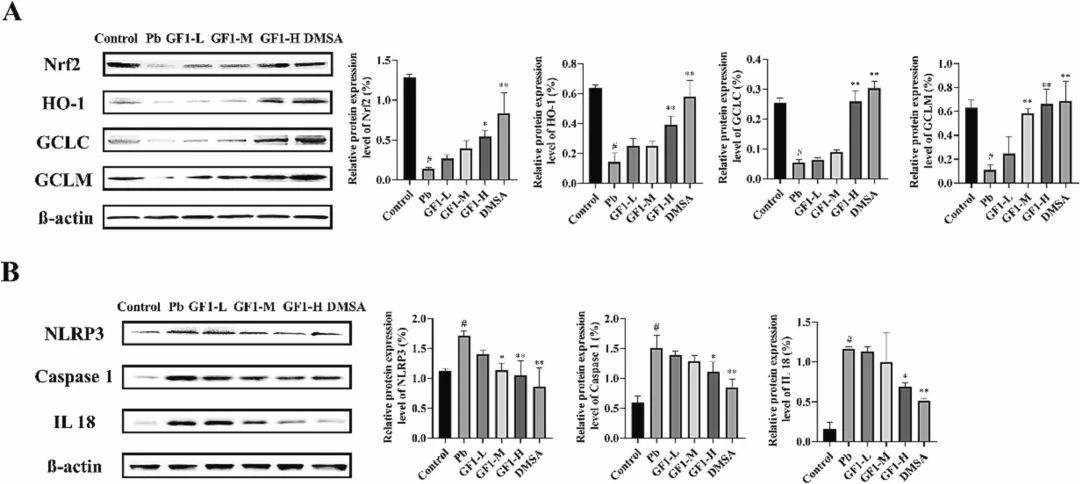
图4 牡蛎铁蛋白(GF1)或DMSA治疗对铅诱导的小鼠肝损伤中Nrf2和NLRP3激活或抑制的影响牡蛎铁蛋白减轻铅诱导的LO2细胞氧化损伤和细胞凋亡如图5A所示,对照组光镜下可见典型的肝细胞形态,而铅组细胞逐渐变圆变小,甚至从细胞培养板上脱落。与铅组相比,牡蛎铁蛋白预保护组细胞具有更好的黏附性和更高的细胞形态。加入5 μg/mL和10 μg/mL铁蛋白后,细胞存活率分别提高15%和34.37%,与铅组比较差异有统计学意义(P<0.01)。图5B显示,浓度为10 μg/mL的牡蛎铁蛋白可以有效地降低细胞中的ROS水平,表明其有可能保护细胞免受铅暴露造成的氧化损伤。染色质凝聚通过Hoechst 33342细胞核染色检测到,这表明铅暴露降低了细胞的活力并诱导了细胞的凋亡。荧光显微镜(图5C)显示染色质凝聚、核固缩等典型的细胞凋亡特征,细胞核内出现淡蓝色斑点。对照组无明显形态改变,呈均匀蓝色。牡蛎铁蛋白处理细胞24 h可减少或消除细胞的凋亡特征。这些发现为牡蛎铁蛋白降低细胞内ROS的能力提供了证据,从而为其细胞保护作用提供了潜在的机制。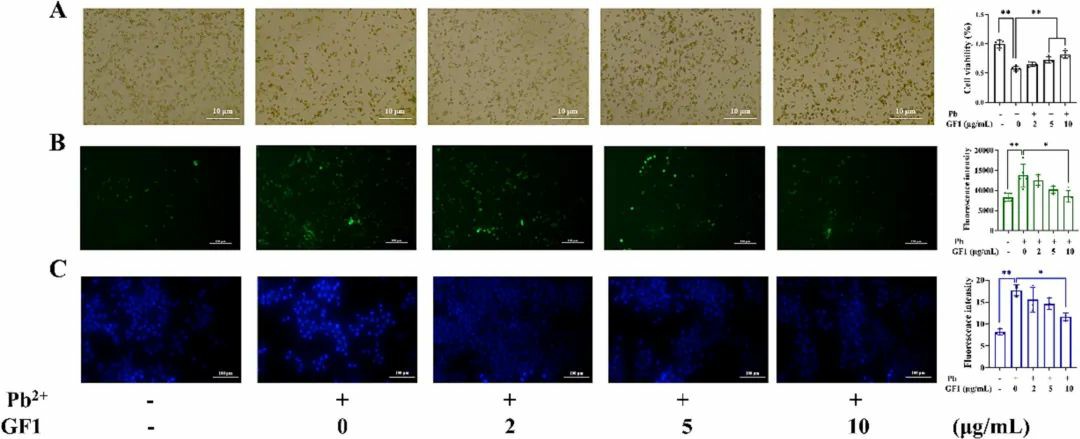
图5 牡蛎铁蛋白(GF1)对铅诱导的LO2细胞损伤的抑制作用牡蛎铁蛋白通过抑制线粒体自噬途径减轻铅诱导的LO2细胞凋亡如图6A所示,对照组的肝细胞显示强烈的红色荧光,带有JC-1聚集体,基本上没有单体。然而,由于膜电位降低,铅暴露的细胞与JC-1单体一起显示出绿色荧光。用10 μg/mL铁蛋白预保护可有效提高正常线粒体比例,减轻铅对线粒体功能的损伤。用透射电子显微镜直接观察线粒体的轮廓、长度、肿胀程度、碎裂程度、形态和数量等线粒体结构特征的变化。结果(图6B)显示对照组线粒体数量较多,形态完整清晰,线粒体脊的数量和形状充足,线粒体基质致密。为了进一步研究其机制,用免疫印迹法检测了自噬相关蛋白。如图6E所示,与对照组相比,染铅组大鼠肺组织中Lc3B-II、Pink、Parkin和Beclin1的蛋白表达水平显著升高(P<0.01)。大剂量铁蛋白干预(10 μg/mL)可显著降低上述蛋白的表达水平(P<0.01),表明大剂量铁蛋白能有效缓解线粒体过度自噬。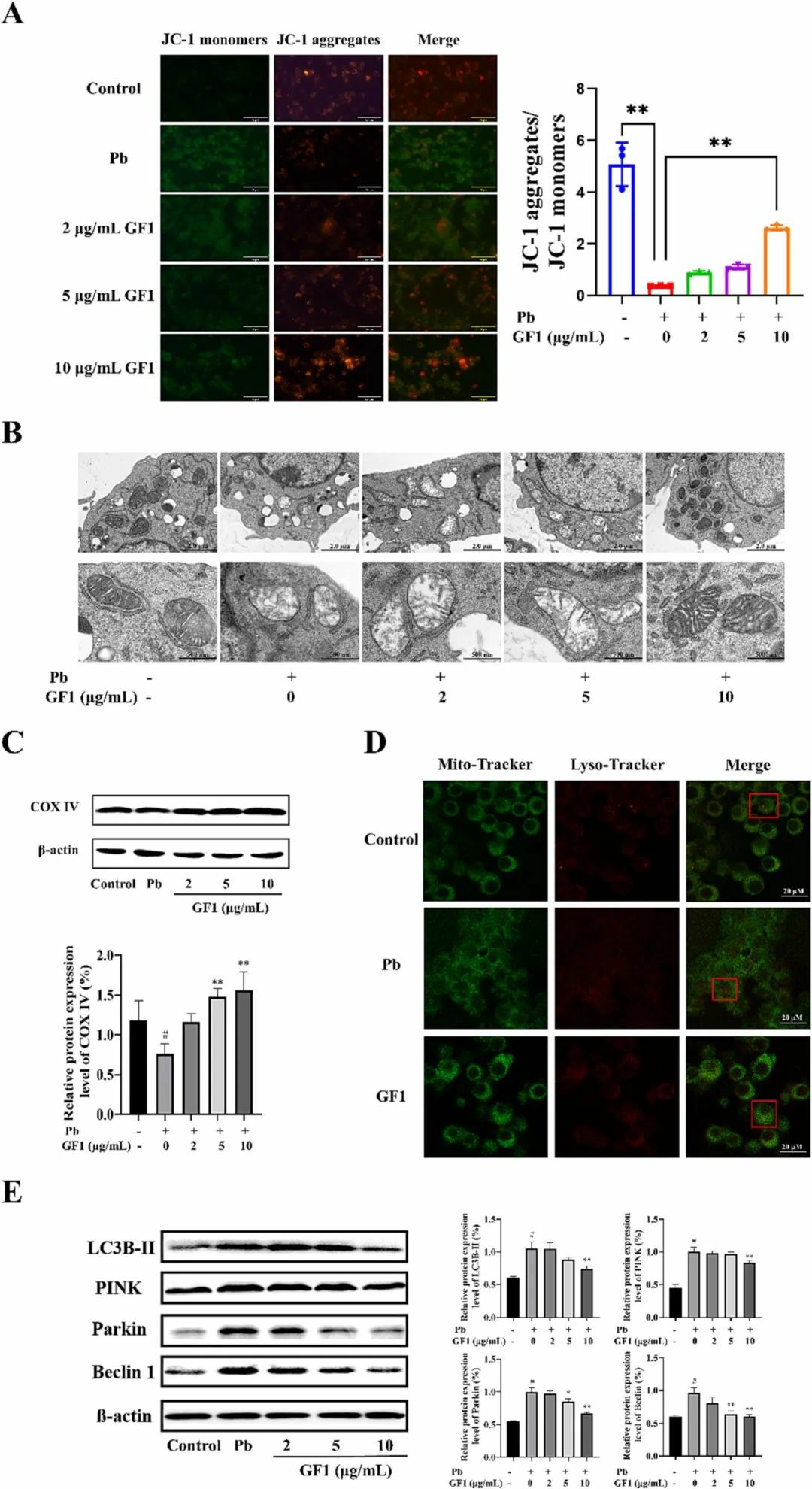
图6 牡蛎铁蛋白(GF1)对抑制LO2细胞有丝分裂吞噬铅诱导的损伤的作用铅一旦通过食物和水进入人体,就会通过血液循环对肝脏等组织器官造成严重损害。铁蛋白可抑制Fenton及Fenton样反应,对铅性肝损伤具有潜在的研究价值。研究表明,牡蛎铁蛋白可以减少铅在体内的积聚,提高抗氧化酶的活性。它还激活Nrf2信号,抑制NLRP3信号,减少氧化应激和炎症。同时,细胞实验结果表明,牡蛎铁蛋白可以减轻铅诱导的细胞凋亡和有丝分裂。本研究为牡蛎铁蛋白改善铅性肝损伤提供了理论依据。
Oyster (Crassostrea gigas) ferritin relieves lead-induced liver oxidative damage via regulating the mitophagy
Han Lia, Xiaoyu Xiaa, Shuzhen Chenga, Jiachen Zangb, Zhenyu Wanga,*, Ming Dua,*
a School of Food Science and Technology, National Engineering Research Center of Seafood, Dalian Polytechnic University, Dalian 116034, China
b College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China
*Corresponding author.
Abstract
Lead can induce oxidative stress and increase lipid peroxidation in biofilms, leading to liver damage and physiological dysfunction. This study aimed to investigate how oyster ferritin (GF1) attenuates lead-induced oxidative damage to the liver in vitro and in vivo. Animal experiments have confirmed that lead exposure can lead to oxidative damage and lipid peroxidation of the liver, and ferritin can regulate the activity of antioxidant enzymes and alleviate pathological changes in the liver. At the same time, oyster ferritin can regulate the expression of oxidative stress-related genes and reduce the expression of inflammasome-related genes. In addition, lead can induce apoptosis and mitophagy, leading to overproduction of reactive oxygen species and cell death, which can be effectively alleviated by oyster ferritin. Overall, this study provides a theoretical foundation for the use of oyster ferritin as a means of mitigating and preventing lead-induced damage.
LI H, XIAO X Y, CHEM S Z, et al. Oyster (Crassostrea gigas) ferritin relieves lead-induced liver oxidative damage via regulating the mitophagy[J]. International Journal of Biological Macromolecules, 2023, 253, 12965. DOI:10.1016/j.ijbiomac.2023.126965.