肉类研究 2020-12-25 17:20 北京
铁蛋白可广泛用作功能纳米材料。但是,铁蛋白的生理活性会在温度过高的情况下受损,从而影响其自组装性能。
大连工业大学食品科学技术学院、国家海洋食品工程技术研究中心的Li Han等在一项研究中,在铁蛋白氨基酸序列的Asp120~Gly120中产生点突变,使其耐热性显著提高。
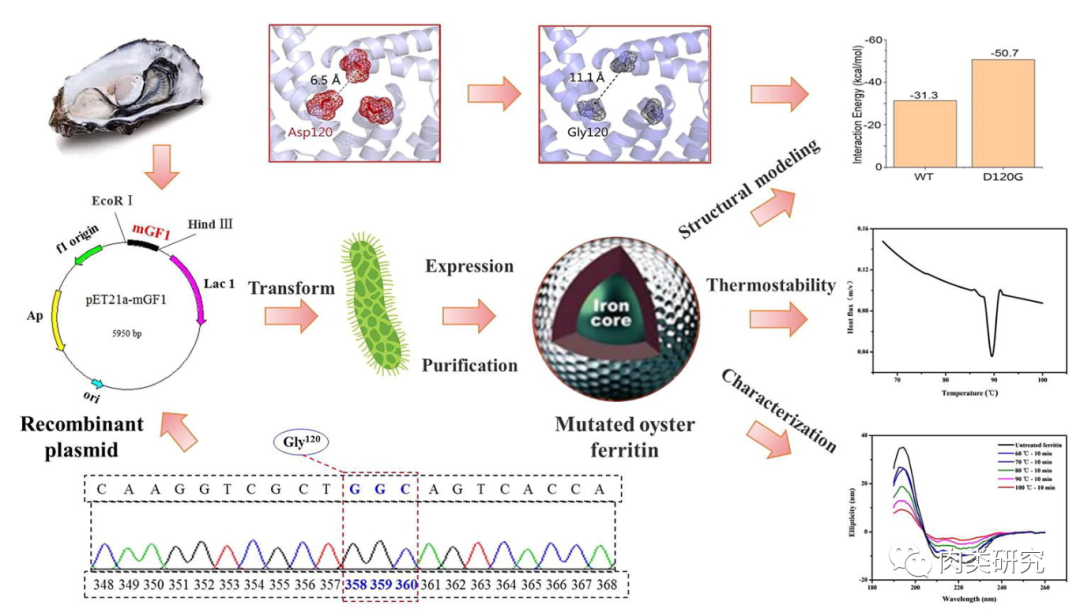
结果表明,突变铁蛋白的热变性温度为89.17 ℃,较野生型牡蛎铁蛋白升高了13 ℃。在温度低于90 ℃时,热处理对铁蛋白变性、聚集状态、粒径和结构的影响没有变化。计算机模拟和分析结果表明,突变铁蛋白通过降低3 倍界面中62%的相互作用能,促进了整体结构的稳定性组装。
通过点突变改善牡蛎铁蛋白的热稳定性,增强了其作为食品成分的应用。
文章《Improvement of thermal stability of oyster (Crassostrea gigas) ferritin by point mutation》发表于Food Chemistry2020年12月24日
大连工业大学食品科学技术学院、国家海洋食品工程技术研究中心的杜明教授为本文通信作者
文章链接:
https://doi.org/10.1016/j.foodchem.2020.128879