原创 食品科学杂志 食品科学杂志 2020-07-24 19:34 北京
自然界中存在着一类具有天然笼形结构的蛋白质,其在结构上具有良好的对称性、稳定性和运载性,近年来逐渐吸引研究者关注。将笼形蛋白中心的物质去除可形成中空的蛋白笼,通常粒径较小的晶体单质分散蛋白载体被称为蛋白质纳米笼。这类结构可以为它所包封的物质提供良好的保护并改善被包封物质的性质,常见的有病毒衣壳、热休克蛋白和铁蛋白(Fn)。Fn是一种广泛存在于生物体内具有储铁和调节铁平衡功能的蛋白质,可作为吸收利用率极高的生物补铁源。Fn的空腔最多可贮存4 500 个铁原子,天然Fn可以作为一种铁补充剂,随着部分Fn可耐受胃环境而被小肠的专一受体吸收的机制逐渐被广泛认同,Fn在作为矿质元素和有机小分子营养强化剂载体上的潜力逐渐显现。大量分离纯化高纯度的Fn是生物纳米运载体系研究的前提和基础。然而,目前Fn的制备通常采用摇瓶培养含Fn基因的工程菌株的方法,虽蛋白质表达效率高但经纯化后获得的纯品量仍然有限,严重限制了其广泛应用。因此,大连工业大学食品学院、国家海洋食品工程技术研究中心的夏小雨、李晗和杜明*等人采用原核表达系统于发酵罐内高效表达人源重链铁蛋白(rHuHF),进而对搅拌转速、空气通量及诱导表达时间3 个关键工艺参数进行优化,确定大量表达目的蛋白质的最佳表达条件,以多技术组合的方法分离纯化获得具有可逆自组装特性的rHuHF纯品。采用透射电子显微镜(TEM)和动态光散射(DLS)对rHuHF的纳米结构及粒径进行表征,DLS、紫外光谱、荧光光谱鉴定rHuHF的可逆自组装活性,以期为基于可逆自组装蛋白纳米运载系统的研究及开发提供理论支持。
1 工程菌BL21-pET3a-rHuHF诱导表达可溶性Fn
通过扩增得到的rHuHF基因全长为552 bp,编码183 个氨基酸,蛋白分子质量为504 kDa。由图1A可知,工程菌BL21-pET3a-rHuHF在发酵罐内培养过程中菌体量呈近似对数增长,培养液浑浊度逐渐上升,OD600 nm逐渐增加。由图1B可以看出,新配制的灭菌LB培养基自然pH值约为6.0,培养期间菌液pH值经短暂的小幅下降后持续上升到发酵结束时的8.0左右。对发酵结束的菌液进行培养液和菌体分离、菌体细胞可溶物(细胞破碎上清液)与不溶物(细胞破碎沉淀)分离,通过SDS-PAGE鉴定目标蛋白的表达位置。
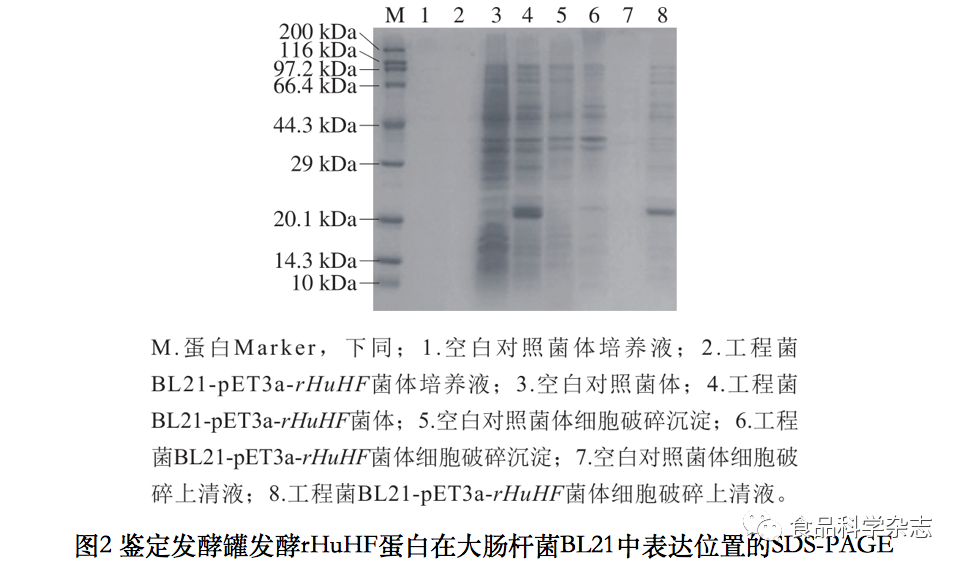
由图2可知,1、2泳道对比可证明发酵液中几乎没有蛋白质存在;与未导入pET3a-rHuHF重组质粒的大肠杆菌BL21(泳道3)相比,工程菌BL21-pET3a-rHuHF(泳道4)在接近20.1 kDa的位置明显多出了一种不属于大肠杆菌BL21本身的蛋白表达条带,说明目标蛋白表达在菌体细胞内部且表达量较高;泳道4和泳道5、6(细胞破碎沉淀)对比可知,导入重组质粒前后的细胞破碎沉淀所含蛋白种类有略微差别,目标蛋白大部分未在细胞破碎沉淀内表达;对比泳道4和泳道7、8(胞内可溶物)可知,导入重组质粒的细胞破碎上清液所含蛋白种类有明显增加,泳道8出现目标蛋白条带,综上所述,目标蛋白大部分表达在胞内可溶物部分,为可溶性表达。
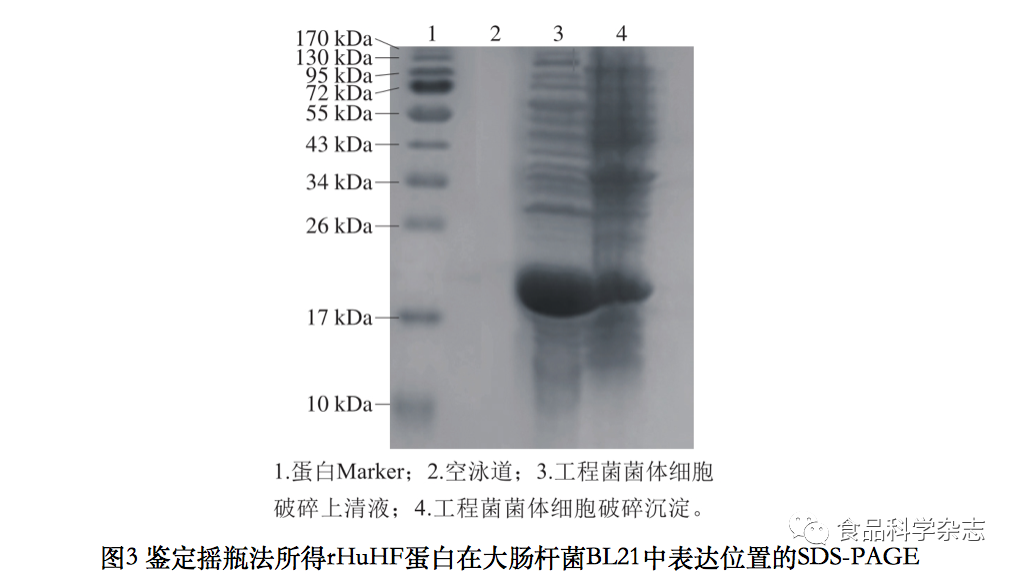
采用摇瓶法培养与发酵罐发酵对比验证发酵罐表达目标蛋白的稳定性,由图3可以看出,摇瓶法表达的目标蛋白分布在菌体胞内可溶部分和菌体胞内不溶物部分。图2、3比较可知,发酵罐表达目标蛋白比摇瓶表达更易产出可溶性形式,原因可能是发酵罐表达条件更加稳定可控,更利于可溶性目标蛋白产出。
为了提高rHuHF蛋白的诱导表达量,对发酵罐发酵培养工程菌BL21-pET3a-rHuHF的关键工艺参数进行优化。前期对表达过程的条件进行了单因素试验,并考虑节约发酵过程的能耗,本实验选择工程菌株培养温度37 ℃、罐内搅拌转速150~250 r/min、空气通量0.8~1.6 L/min、加入IPTG后诱导表达时间8~10 h作为优化范围,所选条件范围内目标蛋白的诱导表达量较多,通过BCA试剂盒定量比较出平均每升发酵液表达目标蛋白量得出最优参数。因为OD600 nm值为1.0时,工程菌的生长进入到平台期,生长速度趋缓,所以选择此时加入诱导剂IPTG。结果显示,第7次试验所得每升菌液的目标蛋白含量最高,因素优组合为搅拌转速200 r/min、空气通量1.6 L/min、诱导表达9 h,且空气通量为最主要影响因素,故从节约能源和尽量获得目标蛋白考虑,选择试验的中等搅拌转速。综上所述,选择搅拌转速200 r/min、空气通量1.6 L/min、诱导表达9 h为最佳表达条件。所进行的9 次发酵中每升发酵液的rHuHF表达量最高可达约290 mg/L,采用最佳条件进行摇床培养所得rHuHF表达量约为190 mg/L,相比之下,发酵罐发酵表达目的蛋白的得率显著提高,具有较高的表达效率。
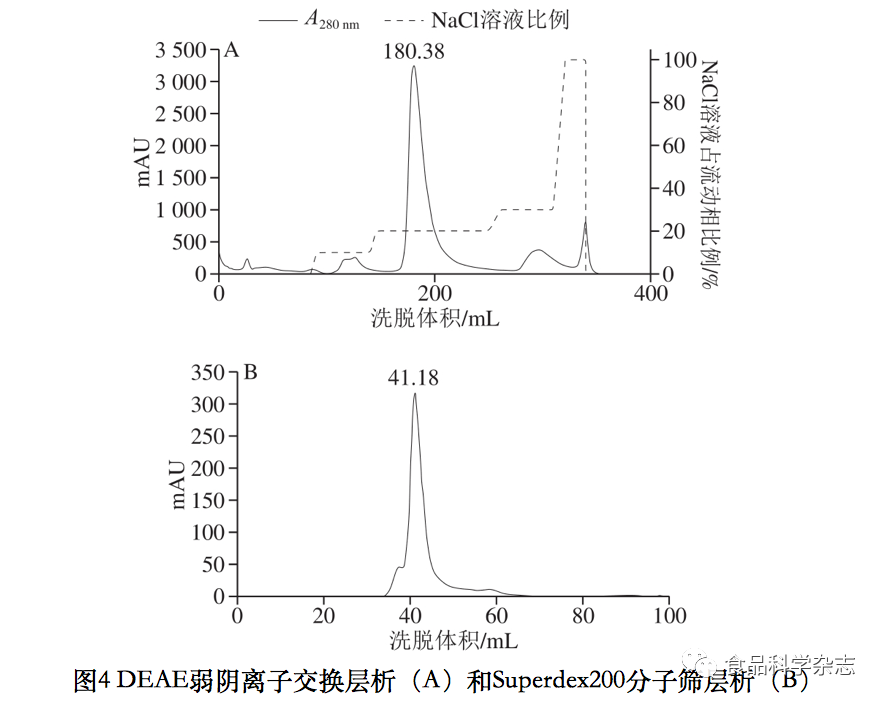
从图4A可以看出,NaCl溶液占流动相比例为20%时洗脱出的峰为目标蛋白峰,其保留体积为180.38 mL,且与其他峰较好地分离,洗脱的rHuHF约占上柱前总蛋白的96%;图4B中保留体积41.18 mL处为目标蛋白峰单体,其左右两个小峰为其多聚体。

由图5可得,弱阴离子交换层析纯化出的目标蛋白达到了电泳纯度且只由相对分子质量接近20 kDa的单亚基构成,与其他研究所述一致,由图6可知,rHuHF在pH 7.5体系内几乎被纯化至均质,表观相对分子质量约440 kDa,目标蛋白条带上方浓度较低的大分子蛋白可能是单体rHuHF蛋白的多聚体形式。综上可说明rHuHF的纯化情况良好,纯度达到电泳纯。
由图8A可知,经DLS测定并拟合得到的rHuHF粒径为(11.23±0.10)nm,粒径分布窄且均一性较强,rHuHF溶液在体系pH值为2时拟合得出的水动力半径为(2.73±0.10)nm(图8B),说明大分子rHuHF纳米笼在pH 2环境下发生解离,从图8C可看出,rHuHF在pH值重新恢复到7后复性,其粒径恢复至(12.03±0.10)nm,紫外和荧光特性均与变性复性前没有明显区别(图8D、E),说明rHuHF在这一过程中保持有良好的可逆解聚和重聚合能力,由于拟合所得水动力半径与H单亚基的宽度和厚度(2~2.5 nm)相接近却小于H亚基的长度,说明极端pH的解离环境可能对蛋白结构有一定的破坏。
本研究优化发酵罐高效表达rHuHF的关键工艺参数,得到的最佳表达条件为搅拌转速200 r/min、空气通量1.6 L/min、表达时间9 h,发酵表达量最高可达290 mg/L;TEM显示表达的单分散性均一rHuHF直径尺寸接近10 nm,rHuHF在pH 7时水动力粒径为(11.23±0.1)nm,pH 2时水动力粒径为(2.73±0.1)nm。本研究对基于可逆自组装Fn的纳米靶向运输系统的研究及开发等工作具有重要意义。